截止2021.6.11,中國疫苗接種數量已經超過8億6千萬劑次;國內企業也早就推出了各類的抗體檢測產品,包括總抗體和中和抗體檢測。對于疫苗效果評估來說,最好的方法還是中和抗體的檢測。但到目前為止,并沒有一項研究明確多少濃度的中和抗體對于新冠具有保護作用,故目前的檢測仍以定性檢測為主,即判斷抗體的有無。
世界衛生組織(WHO)通過國際實驗室間的協作標定,發布了新冠抗體的第一代國際標準品(NIBSC code: 20/136 ),確定了中和抗體的國際單位濃度,為后續定量研究奠定了基礎,下一步可通過研究明確新冠中和抗體的有效保護濃度,如乙型肝炎病毒表面抗體以10mIU/mL為臨界一樣。
除了20/136外,WHO還推出了另外兩個新冠抗體相關產品,分別是20/268和20/130,即國際參考盤和研發用質控品。
今天就來說一下這幾個產品如何使用的兩個基本概念
1)新冠抗體檢測和新冠抗體中和抗體檢測的區別。
如果沒有特殊說明的話,新冠抗體檢測的是總抗體,包括IgG,IgM等不同亞型的抗體、針對不同的抗原表位(根據產品選擇使用的抗原),而中和抗體僅僅是總抗體中的一部分。中和抗體是由病毒最外層的包膜或衣殼抗原刺激機體產生的一類能與病毒結合并使之喪失感染力的抗體。中和抗體作用機制一般包括改變病毒表面構型;與吸附有關的病毒表位結合,阻止病毒吸附,使病毒不能侵入細胞進行增殖;與病毒形成免疫復合物,易被巨噬細胞吞噬清除;有包膜病毒的表面抗原與中和抗體結合后,激活補體,可導至病毒的溶解。這就為什么中和抗體檢測是疫苗研發和臨床評價過程中重要的指標之一。
2)中和抗體的檢測方法
中和抗體的金標準方法是中和試驗,即使用活病毒或者合成病毒與樣本反應,檢測樣本中中和抗體對病毒的殺傷能力,現在發表的疫苗臨床效果評價都是使用這種方法。但這種方法對檢測的要求很高,不適合普通醫療檢測機構推廣使用。
另一種中和抗體的檢測是利用免疫反應原理,通過特定的抗原檢測相應的中和抗體,通俗來說就是把中和抗體從新冠的總抗體中“識別”出來,這種方法適合普通醫療檢測機構推廣使用,關鍵就在抗原的選擇。
WHO關于新冠抗體的三個產品
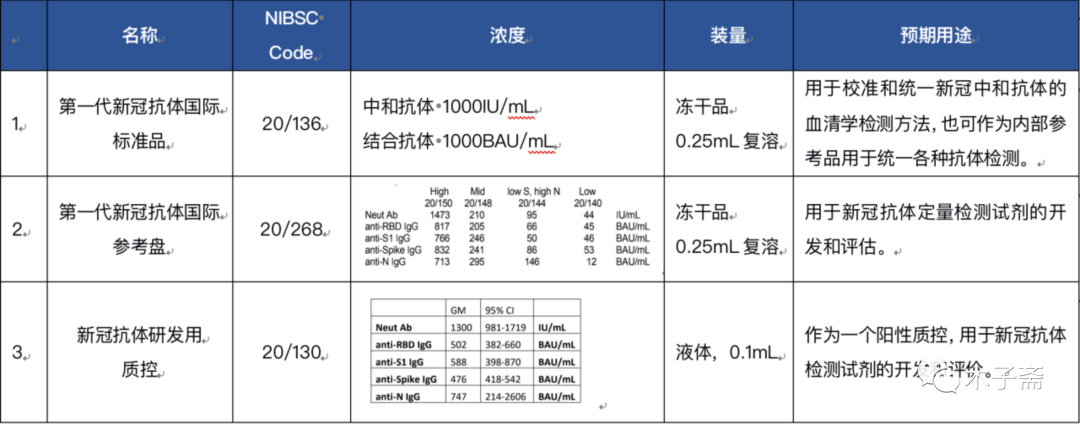
1)WHO三種不同的新冠抗體產品,具體見表1
表1 WHO三種不同的新冠抗體產品
2)20/136和20/268的協作定標過程。
WHO于2020年7-10月,總共匯總了15個國家的44個試驗室的125種方法的結果,進行協作定標;因為樣本入境許可的問題,原計劃參加協作定標的3個中國大陸試驗室未能參與,中國僅香港大學的一個試驗室參與。中和抗體濃度的協作標定匯總了27個中和試驗方法的結果,其中15個方法使用了天然病毒,其余是使用合成病毒;結合抗體的濃度標定匯總了98個方法的結果,包括78個ELISA方法,16個流式細胞檢測,2個免疫層析法,2個抑制試驗;其中抗原以RBD、S1、N和Spike 蛋白四種類型為主,檢測的亞型主要為總抗體或IgG,還包括了IgM(3個方法),IgA(5個方法)。
協作標定組將國際標準品20/136的中和抗體濃度和結合抗體濃度都設定在1000,單位分別是IU/mL(國際單位,International Units)和BAU/mL(結合抗體單位,Binding Antibody Units);要注意,雖然都是1000,但是中和抗體和結合抗體單位不同,實際濃度也不同;結合抗體中針對不同抗原類別的反應性也不相同,只是都賦值為1000。
用20/136為1000的濃度單位對國際參考盤20/268中的四個樣本進行賦值,確定各樣本的不同抗體濃度,包括中和抗體以及針對四個不同的抗原(RBD、S1、N和Spike)的IgG的濃度(IgA和IgM由于得到數據過少,無法統計分析),四個樣本覆蓋了高中低不同濃度。
對于診斷試劑廠家來說,開發定量產品,應先用20/136對產品進行量值溯源,然后使用20/268對試劑進行評估,根據產品檢測抗體的類型對應相應濃度,評價產品的準確度。而20/130可以在研發過程中使用,但是不能用來評估定量準確度。
參考文獻:
1)Mattiuzzo et al. Establishment of the WHO International Standard and Reference Panel for anti-SARS-CoV-2 antibody. 2020, WHO Expert Committee on Biological Standardization. WHO/BS/2020.2403;
2) First WHO International Standard for anti-SARS-CoV-2 immunoglobulin (human) NIBSC code: 20/136 Instructions for use (Version 2.0, Dated 17/12/2020);
3)First WHO International Reference Panel for anti-SARS-CoV-2 immunoglubulin NIBSC code: 20/268 Instructions for use (Version 3.0, Dated 17/12/2020);
4)Research reagent for anti-SARS-CoV-2 Ab NIBSC code 20/130 (Version 2, Dated 17/01/2021);
5)器審中心 | 當前關于新型冠狀病毒中和抗體檢測試劑的幾點考慮,10/02/2021。